結論から言えば、免疫抑制剤の中ではアザチオプリン(通称アザニン)がPSCの治療に有効だと思われます。
このブログ記事では主にアザチオプリン とタクロリムス (商品名プログラフ、グラセプター)について取り上げます。
他にもシクロスポリン (通称ネオーラル)やメトトレキサート 、ミコフェノール酸モフェチル (通称セルセプト)などの免疫抑制剤のPSCへの有効性を調べた臨床試験があるようですが、後述する論文⑤ において、試験では有効性が確認されなかったとあるので、これらについては省略します。
アザチオプリンの保険適用は現在の所、次の疾患に限られます。
(1) 下記の臓器移植における拒絶反応の抑制
腎移植、肝移植 、心移植、肺移植
(2) ステロイド依存性のクローン病の寛解導入及び寛解維持並びにステロイド依存性の潰瘍性大腸炎の寛解維持
(3) 治療抵抗性の下記リウマチ性疾患
全身性血管炎(顕微鏡的多発血管炎、多発血管炎性肉芽腫症、結節性多発動脈炎、好酸球性多発血管炎性肉
芽腫症、高安動脈炎等)、全身性エリテマトーデス(SLE)、多発性筋炎、皮膚筋炎、強皮症、混合性結合組
織病、及び難治性リウマチ性疾患
(4) 自己免疫性肝炎
上記のように肝移植後の拒絶反応の抑制 や、潰瘍性大腸炎の寛解維持 や自己免疫性肝炎 などに対する使用には保険適用されますが、PSCそのものに対しては未だ適用外のようです。
タクロリムスの適応症は以下のものです。
○下記の臓器移植における拒絶反応の抑制
腎移植、肝移植、心移植、肺移植、膵移植、小腸移植
○骨髄移植における拒絶反応及び移植片対宿主病の抑制
○重症筋無力症
○関節リウマチ(既存治療で効果不十分な場合に限る)
○ループス腎炎(ステロイド剤の投与が効果不十分、又は副作用により困難な場合)
○難治性(ステロイド抵抗性、ステロイド依存性)の活動期潰瘍性大腸炎(中等症〜重症に限る)
○多発性筋炎・皮膚筋炎に合併する間質性肺炎
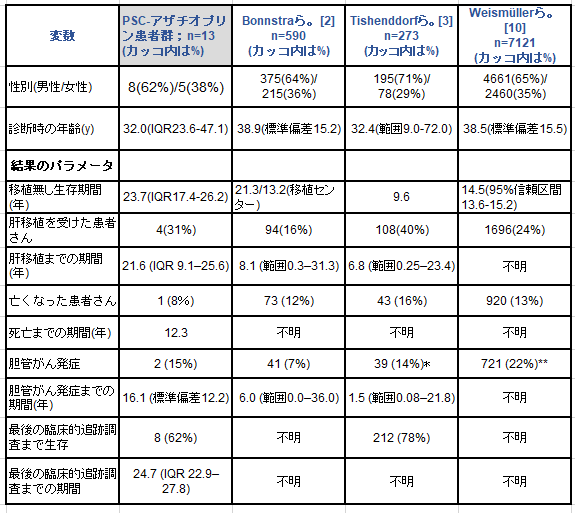
まずアザチオプリンについてですが、後述の論文① によれば25年前 からアザチオプリンの投与を受けている13人のPSC患者さんを追跡調査した所、13人中1人(8%)が診断から12.3年後に胆管がんで亡くなり、13人中4人が肝移植を受け(31%)、13人中8人(62%)の患者さんが肝移植無しで生存しておられるそうですが、肝移植までの期間の中央値は21.6年 (IQR 四分位範囲 9.1-25.6年)であり、全体的な移植無し生存期間の中央値は少なくとも23.7年 (IQR17.4-26.2年)と言うことなので、他の大規模な観察研究における肝移植までの期間の中央値8.1年 (範囲0.3–31.3年)[2] と6.8年 (範囲 0.25–23.4年)[3] や、オランダの移植センターに登録されている患者さんにおける移植なし生存期間の中央値である13.2年と比較して、アザチオプリンによる治療を受けているPSC患者さんは病気の進行が抑制されていると言えます。
また、免疫抑制剤の使用で心配になるのが発がん性です。もとよりPSCは胆管がんを併発しやすく、論文①ではPSC患者さんの最大20%で肝臓や胆道に悪性腫瘍を生じるとあり、MSDマニュアル( https://onl.sc/cAEpfUT )ではPSC患者さんの10~15%で胆管がんを生じるとあるので、やはり免疫抑制剤の発がんリスクは懸念される所です。
アザチオプリンの胆管がん発症リスクについて調査した研究が論文② ですが、結論として、アザチオプリンは胆管がんのリスクに有意に影響を与えなかったということです。 この研究においてはアザチオプリンを投与されたグループの胆管がん発症率は3.3%であり、対してアザチオプリンを投与されなかったグループの胆管がん発症率は6.8%となっていて、むしろアザチオプリン投与を受けた患者さんの方が胆管がんの発症が少ない結果となっています。
また、この研究では胆管がんのリスク増加に関連する唯一の要因は、PSC診断時の年齢が35歳以上であることで、患者さんの性別、炎症性腸疾患の併発、あるいは自己免疫性肝炎は胆管がんのリスクに影響を与え無かったそうです。
そして、論文①における研究においては、25年間の追跡調査の中で、13人中2人の患者さんが、それぞれPSC診断から7.5年と24.8年後に胆管がんを発症していますが、これはアザチオプリン治療とその追跡調査を受けた患者さん全体の15%にあたり、一般的なPSC患者さんの胆管がん発症率の範囲内にあると言えるでしょう。
また、論文②では、アザチオプリン治療を受けたPSC患者さんの方がそうでない患者さんよりも胆管がんの発症率が低かった事や、自己免疫性肝炎の患者さんにおいて、アザチオプリン治療に対する反応が不十分な患者さんで、肝細胞がんの発症率が高くなった事、炎症性腸疾患において、アザチオプリンが炎症誘発性の発がんを妨げることによって結腸癌のリスクを低下させる可能性があることを示すデータが明らかになっている事などから、アザチオプリンの発がん性リスクよりも、炎症を抑える事で発がんを妨げる作用の方が大きい可能性を示唆していると述べていて、PSCと併発した炎症性腸疾患および/または自己免疫性肝炎の患者さんへのアザチオプリン投与を差し控えるべきではないと結論付けています。
但し、炎症性腸疾患においては、最新の研究で、チオプリン治療の結果としてリンパ増殖性疾患や非メラノーマ皮膚がんのリスクの増加が示唆されている事、全体として、炎症性腸疾患におけるアザチオプリンが固形臓器腫瘍、とりわけ肝臓がんのリスクを増加させるという説得力のある証拠は存在しないが、稀なケースではあるものの、アザチオプリンで治療された炎症性腸疾患の患者さんが肝疾患の背景を持っていないのにも関わらず肝細胞癌を発症した症例が存在する事にも留意しておかなくてはなりません。
続いては、タクロリムス(プログラフ、グラセプター) についてです。
論文を読んだ限り、タクロリムスによる治療はある程度の効果が期待できるものの、副作用が強く、患者さんの忍容性が低い ため、現実的ではないと感じました。
タクロリムスに関する研究は、予備試験(論文③ )とそれに続く臨床研究(論文④ )でかなり結果が異なっています。
予備試験の結果はかなり有望な物で、360日間の治療で血清ビリルビン、ALP、ALT、ASTが大幅に減少し、血清尿素窒素とクレアチニンレベルに対する有害な影響は全く観察されなかったとあります。
しかし、この結果を踏まえて行われた臨床研究では、参加した16人の患者さんのうち、13人で薬による有害事象が観察されたそうです。 その13人のうち5人が薬物関連の有害事象のため中断し、2人は登録の後、薬を服用できず、1人は事故で亡くなったとの事。臨床研究を完了出来たのは16人の参加者中、50%にあたる8人だけだったそうです。
肝臓の検査値に関しても、血清ALPの中央値においては有意な低下が観察されましたが(903対483)、ASTの中央値は、統計的には有意であるが、臨床的には有意ではない低下(88対78)しか見られず、総ビリルビンあるいはアルブミンレベルにおいては統計的、臨床的に有意な低下は観察されなかったとの事です。
これらの事から、タクロリムスがPSC患者さんにおける血清ALPを改善することは実証されましたが、患者さんの忍容性が低いため、得られる効果と被るリスクを考慮すると、タクロリムスの臨床的な利点は限定的であると考えられます。
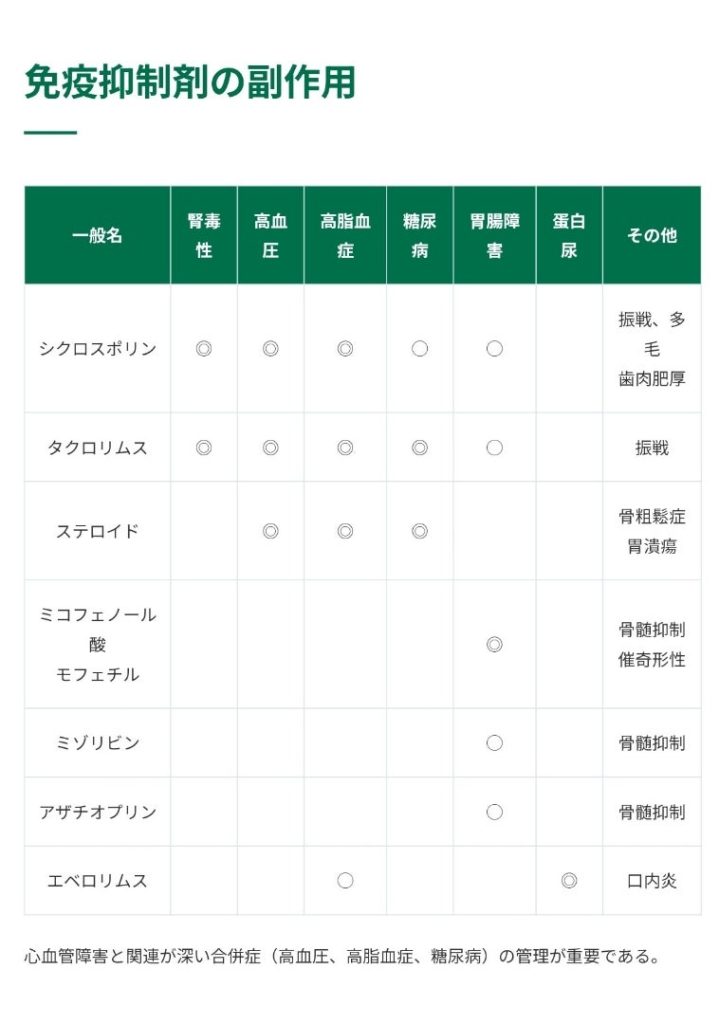
更に、以下は、北海道大学大学院医学研究院のサイトに記載されている免疫抑制剤の副作用が纏められた表ですが、これを見ると、やはりタクロリムスはシクロスポリンを除く他の免疫抑制剤と比べて副作用が多く、長期に渡って服用するには患者さんの負担が大きすぎるように思われます。
論文⑤「21世紀における原発性硬化性胆管炎の治療のレビュー」 においては、アザチオプリン、シクロスポリン、タクロリムス、メトトレキサート、ミコフェノール酸モフェチル などの免疫抑制剤のPSCに対する治療効果について、これまでの研究を基に簡単に纏められています。
やはり、アザチオプリンを投与された患者さんは肝臓組織学、生化学的な改善が見られた事、タクロリムスは副作用が大きいために臨床で用いる利点が限られる事、タクロリムスに構造が似たmTOR阻害剤のシロリムスとエベロリムスはラットにおいて肝臓の線維化を改善し、炎症を低減した事から、これらの薬剤に対する更なる研究が必要とされる事、メトトレキサート、シクロスポリン、ミコフェノール酸モフェチルに関しては、PSC治療での使用を支持する程の有意な効果が見られなかった事が述べられていました。
また、論文⑤では、免疫抑制剤だけではなく、抗生物質 によるPSC治療の有効性にも触れられていて、進行したPSCの患者さんは、細菌性胆管炎を繰り返し発症していて、その事が病気の進行を加速させた可能性があるという事 、現在のガイドラインは、再発性の細菌性胆管炎の患者さんと胆管への介入を受けている患者さんにおいては予防的な抗生物質の使用を推奨している事にも触れられていました。
抗生物質によるPSC治療に関するいくつかの試験において、ミノサイクリンは、ALP値に改善が見られたが、Mayoリスクスコアにおいては有意な改善は見られなかった事、バンコマイシンは、肝臓生化学、炎症マーカー、ALP値、Mayoリスクスコアにおいて有意な改善が見られ、メトロニダゾールはALP値(UCDA併用時)、Mayoリスクスコア、搔痒症において有意な改善が見られたと言う事でした。 なので、特に、腸内微生物叢がPSCの病態に影響を与えている事を示唆する証拠がますます増加して来ている現状を考慮すれば、抗生物質による治療が有望に思われるけれども、やはりここでも抗生物質の使用による耐性菌の進化に対する懸念が示されていました。そして、抗生物質を用いる事なく、腸内微生物叢を変化させる事が出来る糞便移植や胆汁移植がPSCにおける将来的な治療法として検討されるべきであるかもしれないと締めくくられていました。
論文①
以下は
Long-term outcome in PSC patients receiving azathioprine: Does immunosuppression have a positive effect on survival?
という論文の概要を日本語訳したものです。
アザチオプリンを投与されたPSC患者の長期的転帰:
免疫抑制は生存率に有益な影響を与えるか?(2020年8月27日公開)
編集者へ
原発性硬化性胆管炎(PSC)は免疫介在性疾患と考えられています。
その自然な経過は、肝内および/または肝外胆管の進行性狭窄と、それに続く肝硬変への進行[1] 、そして患者の最大20%での胆管がん(CCA)を主とした肝胆道系の悪性腫瘍の発症のリスクが特徴です[2] 。大規模な観察研究では全生存率は、9.6年 [3] から21.3年 [2] で、オランダの移植センターに登録されている患者における移植なし生存期間の中央値は13.2年と報告されています(表1) [2] 。 現在までに、疾患の進行過程を変える医学療法は確立されていません。ウルソデオキシコール酸(UCDA)がしばしば処方されますが、生化学的なパラメータの改善に繋がっているにも関わらず、転帰に対する有益な影響は示されていません[4] 。この疾患の自己免疫的要素を考慮して、幾つかの免疫抑制剤が治療の選択肢として研究されてきましたが、結果は相反しています[5][6] 。
表1.
アザチオプリンによる治療を受けている13人のPSC患者の特徴と結果のパラメータ、および公開された文献との比較
示されている数値とパーセンテージは平均値±標準偏差と対応するIQR(四分位範囲)と範囲を伴う中央値である
*[3] 肝胆管悪性腫瘍が含まれる: 胆管がん36人 胆嚢がん2人 肝細胞癌1人
**[10] 肝膵胆管悪性腫瘍が含まれる:胆管がん559人 胆嚢がん58人 肝細胞癌1人 膵臓がん10人
プレドニゾロンおよびウルソデオキシコール酸と併用したアザチオプリンを評価する最初のパイロットスタディ(予備研究)[5] は25年前に私たちによって行われました。最初の15人の患者さんのうち13人はアザチオプリンによく耐え、この併用療法を続けました。その結果は全体的に有望なもので、すべての患者さんで生化学的なパラメータが急速に低下し、追跡肝生検では10人中6人の患者さんで組織学的な改善が見られました。しかしながら、中央値41か月という観察期間は転帰に与える影響を調査するには短すぎました。それゆえ、ここで、私たちのパイロットスタディに参加し、アザチオプリンによる治療をつづけたこれら13人の患者さんの長期的な追跡データを報告します。
PSCの診断日を開始点として定義し、PSC関連死または肝移植を複合エンドポイントとして定義しました[2] 。患者さんの医療記録が精査され、2020年5月に電話相談によって追跡調査が行われました。表1に患者さんの特徴と転帰がまとめられています。
多くの患者さんは男性で(8人/13人 62%)、PSC診断時の年齢の中央値は32歳(IQR23.6-47.1)でした。最初の研究の終了以来、1人の患者さん(8%)が亡くなり、13人中4人の患者さん(31%)が肝移植を受け、13人中8人(62%)の患者さんが肝移植無しで生存しており、その結果、分析時の肝移植までの期間の中央値は21.6年(IQR9.1-25.6年)であり、全体的な移植無し生存期間の中央値は少なくとも23.7年(IQR17.4-26.2年)でした。2人の患者さん(15%)が、それそれ、7.5年と24.8年後に胆管がんを発症しました。これら2人の患者さんのうち1人は最初のPSCの診断から12.3年後に胆管がんで亡くなり、もう一方の患者さんは、緩和ケアを受けて生存しています。まだ生存していて移植を受けていない8人の患者さんのうち、1人の患者さんとは連絡を取ることが出来ませんでしたが、カルテの確認で彼は2006年の最後の来院時には健在であったことが明らかになっており、分析はこの患者さんに対してはこの時までに限られます。他の6人の患者さんは良好な臨床状態にあり、今日も1日につき50-150mgの用量のアザチオプリンを投与されており、2人の患者さんは追加のプレドニゾロン治療(5mg)を受けています。肝硬変への進行を示した患者さんは1名のみで、現在、末期肝疾患スコア7点のモデルで肝移植の対象になっています。
ここでは、私達の知る限り、アザチオプリンをベースとした免疫抑制剤併用療法を受けたPSC患者さんの最も長期にわたる臨床的追跡調査を報告します。この患者群における移植無し生存期間の中央値は、同様の3次医療機関 [2][3](ブログ主注釈: 高度に専門的あるいは先進的医療を提供する施設) において報告された患者の生存期間を上回っており 、アザチオプリンの使用がPSC患者さんの死亡率の低下[7] と自己免疫性肝炎炎(AIH)とPSCのオーバーラップ症候群の患者さんの転帰の改善に関与する事を示す最近の研究と一致しています。全体的な移植無し生存期間の延長とは別に、文献(表1) で述べられている移植までの期間の中央値6.8年[3] や8.1年[2] と比較して私たちの患者群における4人の移植患者さんは最初の診断の後、中央値21.6年で肝移植を受けたので、私たちのデータは肝移植までの期間の中央値を延長することも示唆しています。
具体的には調査されていませんが、アザチオプリンは忍容性が高く 、今日でもこれらの患者さんの殆どで使用されています。加えて、この患者サンプルは一般的な結論を導き出すには小さすぎるとはいうものの、アザチオプリン治療は胆管がんの割合の増加には繋がりませんでした。 胆管がんはこの患者群では15%で発症しましたが、これは文献[2] で報告された約20%の範囲の内ですし、PSC患者さんにおける胆管がんの発症リスクについてのこれまでの研究[9] に一致します。
要約すれば、私たちはアザチオプリンを投与されているPSC患者さんからの有望な長期に渡る追跡調査のデータを報告します。 アザチオプリンは自己免疫性肝炎の治療に非常に効果的であり、PSC患者さんにおけるインフリキシマブやベドリズマブを含む新たな生物学的治療からの有効性のシグナルの欠如を考慮すれば、おそらく、PSC患者さん、とりわけ、目立った炎症性疾患の活動を伴う患者さんにおいては、このよく知られた薬の使用が考慮されるべきでしょう。
参考文献
[1] https://pubmed.ncbi.nlm.nih.gov/29452711/
[2] https://pubmed.ncbi.nlm.nih.gov/23775876/
[3] https://pubmed.ncbi.nlm.nih.gov/17037993/
[4] https://pubmed.ncbi.nlm.nih.gov/16285948/
[5] https://pubmed.ncbi.nlm.nih.gov/10610645/
[6] https://pubmed.ncbi.nlm.nih.gov/17403184/
[7] https://pubmed.ncbi.nlm.nih.gov/30448601/
[8] https://pubmed.ncbi.nlm.nih.gov/18769363/
[9] https://pubmed.ncbi.nlm.nih.gov/27521513/
[10] https://pubmed.ncbi.nlm.nih.gov/28274849/
論文②
以下は
No Evidence That Azathioprine Increases Risk of Cholangiocarcinoma in Patients With Primary Sclerosing Cholangitis
という論文の概要を日本語訳したものです。
アザチオプリンがPSC患者さんにおける胆管がんのリスクを増加させるという証拠はない
2016年8月10日公開
概要
背景と目的
原発性硬化性胆管炎(PSC)の患者さんは胆管がん(CCA)発祥のリスクが高くなります。
PSCの患者さんは炎症性腸疾患(IBD)または自己免疫性肝炎(AIH)の特徴を抱える可能性があるため、アザチオプリンで治療されます。
アザチオプリンは悪性腫瘍のリスクの増加と関連があるため、私たちはアザチオプリンの使用がPSC患者さんにおける胆管がんのリスクに影響を与えるかどうかを調査しました。
方法
私たちはドイツとノルウェーにある3つの大規模3次医療センターから集められたデータを用いて特定のPSC患者さんの後ろ向き研究を行いました。私たちは638人の患者さん(70%が男性;5900患者年の追跡評価)からのデータを分析しました;91人の患者さんがアザチオプリン治療を受けていました(最初の摂取から90日で有効とみなします)。調査のエンドポイントと競合するリスクがある場合はリスク分析はCox比例ハザードモデル(*) を用いて行われました。
(*)生存時間分析のためのノンパラメトリックな手法の1つで、比例ハザードモデルとも言う。生存時間データのほかに年齢や性別などの共変量を用いることで、共変量が生存時間に与える影響を調べることができる。
結果
アザチオプリン治療を受けた患者さんのうち、3.3%が胆管がんを発症したのに対し、アザチオプリン治療を受けなかった患者さんの6.8%が胆管がんを発症しました。しかし、アザチオプリンは胆管がんのリスクに有意に影響を与えませんでした (ハザード比0.96; 95%信頼区間、0.29-3.13; p=0.94)。胆管がんのリスク増加に関連する唯一の要因は,PSC診断時の年齢が35歳以上であることでした(ハザード比3.87; 95%信頼区間、1.96-7.67; p<.01)。患者さんの性別、炎症性腸疾患の併発、あるいは自己免疫性肝炎は胆管がんのリスクに影響を与えませんでした。全体として、胆管がんの10年累積発生率は4.6%で15年累積発生率は7.7%でした。
結論
ヨーロッパの三次センターにおけるPSC患者さんの後ろ向き分析ではアザチオプリンが胆管がんのリスクに有意に影響を与える証拠は見つかりませんでした。それゆえ、アザチオプリンはPSCと併発した炎症性腸疾患および/または自己免疫性肝炎の患者さんへの投与を差し控えるべきではありません。
以下は、この論文のDiscussion の章の後半部分とそれを日本語訳したものです。
(前略)
These data argue for precursor lesions of CCA to potentially emerge from biliary inflammation. Whether anti-inflammatory treatment impacts the prevalence of dysplasia and CCA in PSC has not been elucidated yet, however, and should best be addressed in a cohort with a regular endoscopic surveillance protocol. This approach would prevent an under-reporting of CCAs in patients undergoing liver transplantation because of high-grade dysplasia. Still, based on the available literature it is conceivable that the relatively low CCA incidence of the patients who received azathioprine may to some extent be a result of its anti-inflammatory effect.
There are no data on the effect of azathioprine on CCA development in other autoimmune liver diseases. In AIH, however, 1 recent study of 180 patients with AIH found no significant association between azathioprine treatment and HCC. In this study, however, the incidence of HCC was significantly higher when patients had an insufficient treatment response.30 Albeit limited by only 6 cases of HCC, this indicates that in AIH the carcinogenic potential of thiopurines may be outweighed by their anti-inflammatory effect.
In IBD, most recent studies have suggested a higher risk of lymphoproliferative disorders and nonmelanoma skin cancer as a result of thiopurine treatment.18, 25, 26, 27, 31 Despite some unusual cases of IBD patients treated with azathioprine without having a background of liver disease and still developing HCC,32, 33 to date there is no convincing evidence that azathioprine in IBD enhances the risk of solid-organ tumors, particularly liver cancer.18 However, data have emerged that show that in IBD azathioprine may lower the risk of colon cancer by inhibiting inflammation-induced carcinogenesis.34, 35
In conclusion, based on this multicenter cohort including a large number of patients with a long observation period, we found no evidence that azathioprine affects the risk of CCA development in patients with PSC. Therefore, in patients with PSC and concomitant IBD and/or AIH, treatment with azathioprine should not be withheld. Furthermore, the relatively low incidence of CCA in PSC patients treated with azathioprine should be re-evaluated in a larger multicentric cohort to assess the effect of anti-inflammatory treatment on CCA development.
これらのデータは胆管がんの前駆病変が胆管の炎症から出現する可能性があることを主張しています。 抗炎症治療がPSCにおける異形成と胆管がんの有病率に影響を与えるかどうかはまだ解明されていませんが、定期的な内視鏡的観察プロトコルをともなう患者群において取り組まれるのが最良であるでしょう。このようなアプローチは、高度異形成のために肝移植を受ける患者さんにおける胆管がんの過少報告を防ぐでしょう。それでも、入手可能な文献に基づくと、アザチオプリンを投与されている患者さんの胆管がんの罹患率が比較的低いのは、ある程度、アザチオプリンの抗炎症効果の結果と考えられるでしょう。
他の自己免疫性肝疾患における胆管がんの発症に対するアザチオプリンの影響についてのデータはありません。しかしながら、自己免疫性肝炎においては、自己免疫性肝炎を患う180人の患者さんを対象とした最近の研究ではアザチオプリンと肝細胞癌の間に有意な関連性は見つかりませんでした。しかし、この研究では患者さんの治療反応が不十分な時に肝細胞癌の罹患率が有意に高くなりました。たった6つの肝細胞癌の症例に限られるとはいえ、このことは、自己免疫性肝炎においては、チオプリンの発がん性の可能性よりも抗炎症作用の方が優っている可能性があることを示唆しています。
炎症性腸疾患においては、最新の研究で、チオプリン治療の結果としてリンパ増殖性疾患や非メラノーマ皮膚がんのリスクの増加が示唆されています。アザチオプリンで治療された炎症性腸疾患の患者さんが肝疾患の背景を持っていないのに肝細胞癌を発症したという珍しいケースがある にも関わらず、今日まで、炎症性腸疾患におけるアザチオプリンが固形臓器腫瘍、とりわけ肝臓がんのリスクを増加させるという説得力のある証拠は存在しません。しかし、炎症性腸疾患において、アザチオプリンが炎症誘発性の発がんを妨げることによって結腸癌のリスクを低下させる可能性があることを示すデータが明らかになっています。
結論として、この長い観察期間を伴う、大規模な人数の患者さんを含む複数施設のコホートに基づいて、アザチオプリンがPSC患者さんにおける胆管がんの発症リスクに影響を与えるという証拠は見つかりませんでした。それゆえ、PSCと併発した炎症性腸疾患および/または自己免疫性肝炎の患者さんにおいてはアザチオプリンによる治療は差し控えるべきではありません。 さらに、アザチオプリンで治療されているPSC患者さんにおける胆管がんの罹患率が比較的低い事は、胆管がん発症に対する抗炎症治療の効果を評価するために、より大きな多中心コホートで再評価される必要があります。
論文③
以下は
Tacrolimus (FK 506), a treatment for primary sclerosing cholangitis: results of an open-label preliminary trial
の概要を日本語訳したものです。
タクロリムス(FK506),原発性硬化性胆管炎治療:非盲検予備試験の結果(1995年3月発行)
原発性硬化性胆管炎(PSC)は進行性の胆汁うっ滞と続発性の胆汁性肝硬変の発症を特徴とする肝臓の慢性炎症性疾患です。抗炎症薬(ステロイド)や免疫抑制剤(メトトレキサート)や抗線維化剤(コルヒチン)、胆汁分泌促進薬(ウルソデオキシコール酸)が幾つかの小規模なシリーズにおいて使用されてきましたが、この病気に対する広く認知された治療は存在しません。本研究では、新しく、強力な免疫抑制性のマクロライド系抗生物質であるタクロリムス(FK506)が10人のPSC患者さんの治療に使用されました。それぞれの被検者はFK506治療の開始の前に肝生検、肝内外の胆管の可視化を伴うERCP、血液学的、血清学的および生化学的臨床試験のパネルを受けました。FK 506は12時間間隔で経口投与され、連続的な血漿FK506トラフ濃度によってモニタリングされました。360日間の治療の後、血清ビリルビンレベルの中央値は75%減少し、血清アルカリフォスファターゼは70%減少しました。さらに、血清ALT(アラニンアミノトランスフェラーゼ)とAST(アスパラギン酸アミノトランスフェラーゼ)はそれぞれ80%と86%減少しました。FK506治療の結果として尿素窒素とクレアチニンの血清レベルに変化は起こりませんでした。 これらのデータは次の事を立証しています。
1)FK506はPSCの治療に使用可能である。
2)PSC患者さんのFK506に対する反応は素早い。
3)血清尿素窒素とクレアチニンレベルに対する有害な影響は全く観察されなかった。
その強力な免疫抑制作用により、FK506はPSC患者さんの治療にとって重要な薬剤となるであろうことが期待されます。
論文④
以下は
Tacrolimus is poorly tolerated by patients with primary sclerosing cholangitis
を日本語訳したものです。
タクロリムスは原発性硬化性胆管炎患者さんには忍容性が低い(2007年8月公開)
Talwalkerら(2007)原発性硬化性胆管炎の治療のためのタクロリムス
パイロット研究の有望な結果を踏まえて、TalwalkerらはタクロリムスがPSC患者さんに本当に安全で有効であるのかを調査しました。血清アルカリフォスファターゼのレベルが正常な上限値の少なくとも1.5倍である16人のPSC患者さんがこの非盲検第Ⅱ相試験に登録されました。参加者は1日に2回0.05mg/kgのタクロリムス(目標全血濃度3-7ng/ml)を一年間投与されました。タクロリムスの用量は9人の患者さんにおいて、彼らの全血タクロリムス濃度、血清クレアニチンレベル、あるいは報告された薬物関連有害事象に基づいて少なくとも一度は調整されました。
薬物関連の有害事象が13人の患者さんで観察されました。8人の患者さんが治療を完了出来ませんでした。:5人が薬物関連の有害事象のため中断し、2人は登録の後、薬を服用できず、1人は事故で亡くなりました。血清アルカリフォスファターゼレベルの中央値の統計的にも臨床的にも有意な低下(903対483、P=0.0001)が治療を完了した8人の患者さんで観察され、 また、統計的には有意であるが、臨床的には有意ではない、アスパラギン酸アミノトランスフェラーゼレベルの中央値の低下(88対78、P=0.002)が観察されました。総ビリルビンあるいはアルブミンレベルにおいては統計的、臨床的に有意な低下は観察されませんでした。
これらの所見は、タクロリムスがPSC 患者さんにおける血清アルカリフォスファターゼレベルを改善することを裏付けているけれども、患者さんの忍容性が低いため、タクロリムスの臨床的な利点は限定的であるとと著者らは示唆しています。
論文⑤
以下は
A review of the medical treatment of primary sclerosing cholangitis in the 21st century
の免疫抑制剤と抗生物質の章を一部抜粋したものの日本語訳です。
21世紀における原発性硬化性胆管炎の治療のレビュー(2016年1月)
アザチオプリン
アザチオプリンは炎症性腸疾患における寛解の維持のために広く使用されているステロイド節約の免疫抑制剤でありプリン代謝拮抗薬です。しかしながら、PSCにおけるその有効性の研究は限られていました。アザチオプリンはRAC-1細胞シグナル伝達を調節することによって、リボヌクレオチド合成を阻害し、T細胞をアポトーシス(ブログ主注釈: 細胞の自然死)に導きます。PSC におけるアザチオプリン使用のいくつかの症例が報告されています。;2人の患者さんが治療によって改善し、1人の患者さんが肝膿瘍によって亡くなりました。アザチオプリン(1-1.5mg/kg/日)とプレドニゾロン(1mg/kg/日)とウルソデオキシコール酸(500-750mg/日)を組み合わせた治療を受けた15人のPSC患者さんの症例シリーズでは肝臓組織学、生化学において有意な改善が観察されました。残念ながら、PSCと炎症性腸疾患の併発がありふれていることは、多くのPSC患者さんがPSCの診断と進行時にアザチオプリンを服用している事を意味し、この事は、アザチオプリンの更なる評価に対する熱意の欠如を説明するかもしれません。しかし、PSCにおいてチオプリン代謝物測定値の使用を行った試験も不足しています。
シクロスポリン
シクロスポリンはT細胞の細胞質のシクロフィリンに結合してカルシニューリン(ブログ主注釈: 細胞内シグナル伝達に関与するプロテインフォスファターゼの一種) を阻害し、続いてインターロイキン2の転写を阻害します。この事は、T細胞の応答を阻害する一方で、制御性T細胞の生成をも制限する可能性があります。24か月の治療の後、シクロスポリンは肝臓の組織学的変化の進行を防止しました。:偽薬で治療された患者さん10人のうち9人が組織学的な進行を示したのに対し、シクロスポリンで治療された患者さんは20人のうち11人が組織学的な進行を示しました(P<0.05)。しかしながら、症状や肝臓生化学、あるいは疾患の進行に対する影響が不足していたため、シクロスポリンはPSCの治療には効果がないという結論に至りました。シクロスポリンは、さらに、35人の潰瘍性大腸炎を併発した肝硬変前期のPSC患者さんを対象とした二重盲検ランダム化比較試験で評価されました。PSC-UC患者さんは、症候的な腸疾患においては改善を経験した一方で、この試験は、主として、潰瘍性大腸炎に対する影響を立証するためのものであり、この治療によってはPSCが関連した評価項目に違いは観察されませんでした。
タクロリムス
10人のPSC患者さんを対象としたタクロリムスの予備的な非盲検試験が肝臓生化学の有意な改善を実証しました。この効果はタクロリムス(0.05mg/kg/日)で治療された16人のPSC患者さんを対象とした非盲検第Ⅱ相研究において確認されました。しかしながら、患者さんのうち50%しか1年の治療を完了できず、31%が薬物関連の有害事象のためにこの試験を辞退しました。さらに直腸結腸切除術を受けた患者さんが多数含まれることは、胃腸に対する副作用の頻度がより大きいことを説明しているかもしれません。研究は、この患者集団において臨床的な利点は限定的であり、タクロリムスは忍容性が低いと結論付けました。シロリムスとエベロリムスはラパマイシン標的タンパク質(mTOR)の阻害剤であり、最近の証拠はこれらのmTOR阻害剤は胆管結紮(血管を縛ること) ラットにおいて肝臓の繊維化を改善し、炎症を低減することを示しています。これらはPSCおよび胆管がんの潜在的な治療標的となる可能性があります。それゆえ、これらの薬剤を評価するためにさらなる研究が必要とされています。
メトトレキサート
メトトレキサートはプリン代謝に関与する酵素を標的とするジヒドロ葉酸還元酵素阻害剤であり、T細胞の活性と接着分子の発現を抑制し、抗炎症特性をもたらします。0.2/mg/kg/週のメトトレキサートを経口投与する予備試験では肝臓生化学において統計的に有意な改善を示しました。1年で9人中6人(66%)が組織学的な改善を示し、再度胆管造影を受けた6人中3人(50%)が改善を示しました。対照的に、24人のPSC患者さんに経口メトトレキサートを投与する前向きプラセボ対象ランダム化比較試験では、2年の治療の後、肝臓組織学、胆管造影の所見、あるいは肝臓生化学において変化は示されませんでした。しかしながら、治療群の58%が肝硬変を発症したのに対して、プラセボ(偽薬)を投与された患者群では42%しか肝硬変を発症しなかったことは注目されるべきであり、このことはこの試験において観察されたメトトレキサートの有効性の欠如を明らかにしています。
ミコフェノール酸
ミコフェノール酸モフェチル(MMF)は固形臓器移植において第二選択薬としてアザチオプリンに大体的に取って代わった強力な免疫抑制剤です。MMFは新たなプリン合成を阻害することによってBリンパ球およびTリンパ球の増殖を減衰させます。
安全性と有効性を確認することを目的として、30人のPSC患者さんに1-3gのMMFを投与する予備研究;
77%が1年の治療を完了し、33%が副作用を経験したが、服用量を減らすことで解消しました。血清ALPにおいて、有意ではあるが、臨床的にはわずかな減少が観察されましたが、パイロット研究はPSCにおけるMMFの単独使用を支持しませんでした。これらの結果はMMF(1g/1日2回)とウルソデオキシコール酸(13-15mg/kg/日)の併用(12人)とウルソデオキシコール酸単独(13人)を比較する二年間のランダム化比較試験によって裏付けられました。
サンプルサイズが小さいこと、非盲検であること、そして高い脱落率が第二種過誤(ブログ主注釈:βエラー;例えば、薬効があるのに無いと判定されるエラー) につながった可能性があるが、この試験からの結果はPSCにおけるMMFとの併用療法を支持するものではありませんでした。
抗生物質
PSC治療における抗生物質の潜在的な役割は、当初、小腸内の細菌の異常増殖が胆管の狭窄と門脈炎症を引き起こすラットモデルにおける実験的な証拠によって導かれました。重要なのは、進行したPSCの患者さんは、細菌性胆管炎を繰り返し発症していて、その事が病気の進行を加速させた可能性があるという事です。 内視鏡的逆行性胆管膵管造影(ERCP)と摘出された肝臓から得られた胆汁液の研究は、胆管への介入を多数受けた患者さんとERCP未経験の患者さんのうち25%の両方において広範囲の細菌と菌類を示しました。したがって、現在のガイドラインは、再発性の細菌性胆管炎の患者さんと胆管への介入を受けている患者さんにおいては予防的な抗生物質の使用を推奨しています。
PSCにおける抗生物質に関するいくつかの小規模な試験がありました。16人の患者さんを対象とした、抗アポトーシスおよび抗炎症特性をもつミノサイクリンの一年間の予備研究では、ALPに有意な改善が観察されました(p<0.05)。しかしながら、Mayoリスクスコアにおける改善は統計学的に有意ではありませんでした。80人のPSC患者さんを含む最大規模の抗生物質の試験が三年間のランダム化比較試験においてウルソデオキシコール酸単独に対するメトロニダゾールとウルソデオキシコール酸の有効性を評価しました。血清ALPとMayoリスクスコアにおいて有意な減少が観察されましたが、肝臓組織学と胆管造影の所見における改善は統計学的に有意ではありませんでした。PSC-炎症性腸疾患を患う14人の小児における経口バンコマイシンの長期治療は、とくに肝硬変がない場合に、肝臓生化学と炎症マーカーと症状を有意に改善しました。 更に最近、12週間、一日に4回の125mgあるいは250mgのバンコマイシンか一日に3回のメトロニダゾールを投与するように無作為に割り当てられた35人のPSC患者さんを対象とした小規模なランダム化比較試験がいくらかの有効性を実証しました。ALP正常化の主要な評価項目は低用量バンコマイシン群と高用量のバンコマイシン群の両方で達成されました。Mayoリスクスコアは低用量バンコマイシン群とメトロニダゾール群の両方で有意に低下し、高用量メトロニダゾール群において掻痒症が有意に減少しました。 この有望なデータが、PSCにおける肝臓生化学を改善する上でのバンコマイシンの有効性を確認するためのより大規模な臨床試験を促進し、それは現在進行中です( https://clinicaltrials.gov/ct2/show/NCT01802073 ブログ主注釈:リンク先の論文を読むと、この試験は既に大部分完了しており、小児の患者さんの殆どと大人の患者さんの半数以上でALTとγ-GTP、MRCP所見における改善が見られたというポジティブな結果になっていました ) 。それゆえ、とりわけ、PSCにおける腸内微生物叢の役割に関する証拠の増加を考慮すると、抗生物質治療は有望に思われるけれども、耐性の進化に対する懸念は依然として臨床医の重要な懸念です。微生物叢を変化させることができる糞便移植や胆汁移植を伴う将来的な治療法がPSCにおける重要な検討事項かもしれません。