英国のバーミンガム大学とインペリアル大学が共同で進めているPSCの患者さんに対する糞便微生物叢移植 (faecal microbiota transplant :FMT)の研究に、Lifearc社(※注1)という希少疾患の研究を支援している医学研究慈善団体が研究資金の提供を行ったという記事がありました。
糞便微生物叢移植と言っても、勿論、糞便をそのままの形で移植する訳ではなく、健康な人に糞便を提供して貰い、そこから抽出した微生物だけが含まれた液体を、内視鏡、浣腸、栄養チューブ、または特別な種類のカプセルなどの手段で患者さんの腸内に送達します。なので、「糞便」という言葉からくる心理的な抵抗感は実際の処置に際しては、それ程無いかと思われます。
この試験を主導しているバーミンガム大学のパラク・トリベディ博士は、「私たちの試験でFMT(糞便微生物叢移植)がうまく機能することが示された場合、この研究を完了してから5年以内に患者が恩恵を受けることを見込んでいます。」と述べています。
プロジェクト概要によれば、
研究開始日は2022/2/1で研究期間は48ヶ月と言う事なので、研究完了は2026年の始め頃になるかと思われます。そこから5年以内となるとまだ先の長い話ではありますが、近年、PSCの主要な病因の一つとして考えられるようになった腸内微生物叢に直接アプローチ出来る貴重な治療法として今後の展開に注目していきたいと思います。
ただ一点、非常に気になったのが、これまでに行われた糞便微生物叢移植の研究に関する論文を探してみた所、2つ見つかり、一つは、治療の結果、患者さんのALT値が低下し、有害事象も発生しなかったという有望なものでしたが、2つ目の論文は、糞便微生物叢移植によって、治療後一年間は肝機能検査値が大きく改善し、PSCの症状もなく過ごせていたが、患者さんの腸内微生物の存在量を調べた所、糞便微生物叢移植後4週間辺りの時点から既に、PSCの患者さんの腸内から高確率で検出されPSCの原因の一つではないかと疑われているクレブシエラ菌とエンテロコッカス菌の増加が見られていたとのことで、この治療は短期的には症状を改善し、移植無し生存期間を延長する効果があっても、長期的に見てメリットばかりとは限らないのでは無いかという事です(勿論、クレブシエラ菌やエンテロコッカス菌の増加は、糞便微生物叢移植とは無関係な別の要因によって引き起こされたものである可能性もあります)。今回のバーミンガム大学とインペリアル大学の共同研究によって、糞便微生物叢移植のポジティブな治療効果だけでなく、リスクについても慎重に調査され、患者さんが安心して治療を受けれる状態で、実用化に繋げて頂きたいと思います。
(注1)Lifearc社とは
英国の医学研究機関であるMedical Research Councilを母体とする非営利の医学研究慈善団体で、研究室にある科学的なアイデアを患者さんの人生を変えるような医学的なブレークスルーに変える支援を行っています。LifeArcはこの活動を25年以上継続しており、5つのライセンス医薬品や、抗生物質耐性の診断薬などを生み出しています。LifeArcは、未だ満たされていない医療ニーズの高い分野に2030年までに13億ポンドを費やすことを約束しています。
希少肝疾患を治療するための独自の方法を調査する新しい研究
ベンジー・コールマン著 2022年2月15日
https://www.imperial.ac.uk/news/233874/new-study-explores-unique-approach-treat/
体が自己の肝臓を攻撃する希少疾患を治療するために腸内細菌を変化させる新しいアプローチを使用する新規の研究に資金が提供されました
バーミンガム大学のPalak Trivedi博士によって主導され、インペリアル大学の研究者たちと共同で進められているFARGO (FAecal microbiota transplantation in primaRy sclerosinG chOlangitis : pscにおける糞便微生物叢移植) 試験では ”faecal microbiota transplant:糞便微生物叢移植(FMT)” がPSCの進行を遅らせ、患者の生活の質を改善する事ができるのかどうかが分かります。
PSC は、英国で約3,600人が罹患している稀な肝疾患です。あらゆる年齢層でこの症状を発症する可能性がありますが、最も一般的なのは40歳未満です。
PSCでは、体の免疫系が肝臓を攻撃し、胆管の炎症と瘢痕化を引き起こします。これにより胆汁の適切な流れが停止し、患者は感染症を繰り返し、肝不全を発症し、場合によっては癌を発症します。5 人中 4 人では、体の免疫システムが腸も攻撃し、肝臓病だけでなく炎症性腸疾患 (IBD) を引き起こします。PSC と IBD の組み合わせにより、全患者の約 3 分の 1 が大腸がんを発症する可能性があり、患者は大腸がんのスクリーニング(※注2)のために毎年結腸内視鏡検査を必要とします。
(注2)スクリーニング検査とは、選別試験、ふるい分け試験のことで、症状のない者やある特定疾患が懸念される集団を対象に検査を行い、目標とする疾患の罹患者や発症が予測される患者を検出するための検査である。
PSC患者の腸内に存在する微生物は、肝臓や腸に炎症がない人の腸内微生物とは異なることが知られています。この腸内微生物の不均衡は多くの異常な免疫機能と関連しており、それがこの症状の発症を引き起こす可能性があります。
FARGO研究では、研究チームは健康なドナーの腸から天然微生物を含む便を採取し、研究室で精製してPSC患者の腸に移すことで腸内微生物の不均衡を逆転できるかどうかを調べる予定です。この治療法は、糞便微生物叢移植 (FMT) と呼ばれます。初期の研究では、炎症性腸疾患の治療にも役割を果たす可能性があることが示されています。
代謝・消化・生殖部門の研究者 は、バーミンガム大学、ロイヤル・フリー・トラスト、ノーフォーク大学病院とノーリッチ大学病院の研究者と協力して、この新しい治療方法をテストする臨床試験を実施する予定です。この研究に参加するPSC患者は、週に1回、8週間にわたってFMTを受けるか、偽薬(不活性なFMTに相当するもの)のいずれかを投与されます。各グループは引き続き、炎症性腸疾患 に対する通常の日常的な標準治療を受けます。
研究チームは両グループをさらに40週間観察する予定です。その後、チームは肝臓血液検査の改善、肝臓の瘢痕化の軽減、炎症性腸疾患の重症度の軽減、症状と生活の質の改善において、治療がどの程度成功したかを測定します。
治験に参加したインペリアル大学のチームの一人であるベン・マリッシュ博士は、「当部門は長年にわたり、腸疾患や肝臓疾患を助けるための糞便微生物叢移植の研究に深く関わってきました。治験の臨床面を支援するだけでなく、インペリアル大学チームはまた、国立現象センターの最先端のメタボロミクス技術(※注3)を使用して、研究参加者から収集したサンプル中の胆汁酸やその他の化学物質を分析する予定でもあります。これは、FMTが患者を助けるメカニズムを、これまでの研究では行われていない詳細なレベルで調査するのに役立ちます。」
(注3)メタボロミクスとは、生命活動によって生じる代謝物を網羅的に解析することで生命現象を明らかにしようとする研究分野
NIHR(国立衛生研究所)バーミンガム生物医学研究センターでこの試験を主導しているパラク・トリベディ博士は、「この研究は、どの腸内微生物が最も重要なのか、そしてこの潜在的な治療法をより多くの人を治療するためにどのように拡大できるのかを理解するのに非常に役立ちます。私たちの研究は、FMTもっと世界中で利用できるようにするためのより大きな将来的な作業の基礎を築くでしょう。」と述べました。
「私たちの試験でFMTがうまく機能することが示された場合、PSC supportは患者にできるだけ早くFMTを利用することを推奨します。これにより、私たちがこの研究を完了してから5年以内に患者が恩恵を受けることを見込んでいます。」
現在、医師は症状の管理のみによってPSCを治療しています。PSCの原因は完全には理解されておらず、治療法もありません。肝移植が唯一の救命治療法です。非常にまれな疾患ではありますが、PSC は英国における肝移植全体の 10 件に 1 件を占めており、現在ヨーロッパのいくつかの国で肝移植の主な理由となっています。
肝移植は命を救うものではありますが、リスクを伴うものであり、NHS(英国の国民保険)にとっては費用もかかります。移植を受けた人は、新しい肝臓が拒絶反応を起こさないように複数の薬を服用しなければなりません。PSCは肝移植を受けた人の約3分の1で再発する可能性があります。
この研究に不可欠な資金は、LifeArc と患者主導の組織であるPSC Supportから提供されています。
LifeArc のカトリオナ・クロンビー博士は次のように述べています。「資金提供に対する私たちの働きかけは、他者と協力して、患者が直面する複雑な医療問題を解決できるかもしれない有望な研究の可能性を明らかにすることです。PSCサポートと共同でこのプロジェクトに資金提供できることを嬉しく思います。これにより、トリベディ博士のチームは鍵となる疑問に答えを出す事が出来、この実験的治療法を研究室のアイデアからPSC患者に希望を与えることができる診療所へと移行させる事ができるでしょう。」
続いては、これまでに行われたPSCの患者さんに対する糞便微生物叢移植の小規模な臨床試験についての2つの論文を紹介します。
1つ目は
10人のPSC患者さんを対象としたパイロットスタディ(※注4)で全体の30%(10人中3人)に50%以上のALTレベルの低下が見られ、有害事象を経験することもなく、PSCにおけるFMT(糞便微生物叢移植)の安全性を実証する事が出来たと言う事です。
(注4)パイロットスタディとは:
本格的に研究プロジェクトを開始する前に、その研究デザインの実現性を見極めるために行う予備的な小規模調査です。
https://pubmed.ncbi.nlm.nih.gov/30730351/
2019年7月
原発性硬化性胆管炎患者における糞便微生物叢移植:パイロット臨床試験
概要
背景: 原発性硬化性胆管炎 (PSC) は、有効な医学的治療法がない胆汁うっ滞性肝疾患です。腸内微生物叢の混乱が PSC に関連して報告されており、他の疾患の状態においては、糞便微生物叢移植 (FMT) が微生物叢を回復することが報告されています。したがって、我々は、FMT後のPSC患者における安全性、肝酵素、微生物叢、およびメタボロミクスデータの変化を評価することを目的としました。
方法: 炎症性腸疾患を併発し、アルカリホスファターゼ(ALP)が正常値の上限の1.5倍を超えるPSC患者を対象とした非盲検パイロット研究が実施されました(注: 非盲検試験とは患者さんがどの何の治験薬を服薬しているかがわかる試験の事)。患者は結腸内視鏡検査による FMT を 1 回受けました。肝酵素データ、便微生物叢およびメタボロミクスの分析は、ベースライン(注:5)および FMT 後 1、4、8、12、24 週間目に実施されました。一次評価項目は安全性であり、二次評価項目はFMT後24週までにALPレベルがベースラインから50%以上低下することでした。(16S rRNA 遺伝子分析によって)糞便微生物叢 とメタボノミクス動態が評価されました。
(注5)ベースラインとは臨床試験等で、治療を開始する前または薬剤を投与する前の状態、もしくはそのときの患者さんの各種臨床検査値などのデータのことを指します。
結果: 10 人の患者が FMT を受けました。9人の患者は潰瘍性大腸炎を患っており、1人はクローン病を患っていました。平均ベースライン ALP レベルは 489 U/L でした。関連する有害事象はありませんでした。全体として、30% (3/10) が ALP レベルの 50% 以上の低下を経験しました。多様性は、FMT 後のすべての患者において、早くも 1 週目に増加しました (P < 0.01)。重要なことに、FMT 後の患者における生着OTU(こ注6)の豊富さは、ALP レベルの低下と相関していました (P = 0.02)。
(※注6) OTU(operational taxonomic unit): 細菌の必須遺伝子(一般に,16SリボソームRNA遺伝子)の塩基配列をコンピュータ上でその類似度を指標に分類したときに得られる単位をいう
考察: 私たちの知る限り、これは PSC における FMT が安全であることを実証した最初の研究です。さらに、細菌の多様性の増加と生着は、PSC 患者の ALP の改善と相関している可能性があります。
2つ目の論文は、肝臓移植後のPSC患者さんに特有の症状である再発性急性細菌性胆管炎(Recurrent acute bacterial cholangitis)に対する治療として糞便微生物叢移植を受けた患者さんについてのものです。(※Recurrent acute bacterial cholangitisで検索しても他の論文がヒットしないので、まだ広く認知された症状ではない可能性があります。若しくは逆に、一般的すぎて改めて論文に取り上げる必要性がないほどよくある症状なのか、、、。)
この患者さんは、週に一回合計4週間に渡って、糞便微生物の移植を受け、治療から9ヶ月後には治療開始時6.8あった総ビリルビンが2.0にまで減少し、ALTが128から56へ、ALPが456から214へ、γGTPが332から164まで低下しました。しかし、一年後に胆管炎を再発し、患者さんは再び糞便微生物叢移植の2サイクル目を受ける事を勧められましたが、これを拒否し、肝臓移植を受ける事を選択しました。この時、患者さんの腸内には治療開始時には存在しなかった病原性細菌が存在し、炎症促進性の腸内作用を有し、PSCの原因と成り得るクレブシエラ菌やエンテロコッカス菌が増加していたとのことです。これが糞便微生物叢移植による結果なのか、別の要因によるものなのか、それとも、糞便微生物叢移植の治療効果は短期的な実施では限定的になってしまうのかを明らかにするには更なる研究が必要ということです。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6328734
2018年12月28日
原発性硬化性胆管炎における再発性細菌性胆管炎に対する健康なドナーの糞便微生物叢移植 – 単一症例報告
概要
再発性急性細菌性胆管炎は、原発性硬化性胆管炎における肝移植に特有の症状です。我々は、原発性硬化性胆管炎患者における再発性急性細菌性胆管炎の治療に対する健康なドナーの糞便移植の有用性に関する最初の報告を発表します。我々は、再発性胆管炎の改善に関連する腸内細菌叢移植後の肝臓生化学、胆汁酸、細菌群集の顕著な変化を実証します。
導入
原発性硬化性胆管炎(PSC)は、慢性胆管炎症と肝臓内および/または肝臓外の胆管系の線維化を引き起こし、肝硬変、場合によっては胆管系の悪性腫瘍に繋がる、複数の病因機序を持つ稀な疾患です。現在利用可能な標準的な医学療法は全生存期間に利益をもたらさず、依然として肝臓移植(LT)が唯一の治癒的療法のままです。腸内微生物叢は、PSC の病態生理学における中心的な要因として関与してきました。
Tabibianと同僚らは胆道損傷に対する保護における共生微生物叢とその代謝物の重要性を実証し、PSCにおいて微生物叢に基づくバイオマーカーや治療的介入などの将来の指針を示唆しました。
微生物叢がPSCの病因および進行に重要な役割を果たしているという事実は、肝臓の生化学を効果的に改善することが示されているメトロニダゾールやバンコマイシンなどの抗生物質を利用した複数の試験を通じて証明されています。SabinoらはPSC患者の腸内微生物組成を調査し、PSCが炎症性腸疾患とは独立した独特の微生物的特徴を有することを実証しました。これらのデータは、腸内細菌叢の操作が PSC の疾患の進行に潜在的に影響を与える可能性があることを示唆しています。
Dominant stricture(※注7)の有無にかかわらず、集中的な医学的治療に反応しない再発性急性細菌性胆管炎(BC)は、PSC患者における肝臓移植に特有の症状です。私達はここで、PSCに関連した再発性急性細菌性胆管炎(BC)を有する患者さんの新しい臨床的データとメタゲノム(※注8)的データを提示します。
彼は肝臓移植のリストに掲載されていましたが、健康なドナーの糞便微生物叢移植(FMT)後1年間、細菌性胆管炎の症状が改善しました。
(※注7)Dominant stricture とは,径 1.5mm 以下の総胆管狭窄または左右肝管分岐部から 2cm 以内に存在する径 1.0mm以下の肝管狭窄と定義されている
(※注8)メタゲノム: 環境中のゲノムの集合体を指す。便中であれば、宿主・微生物・食物(動物・植物)由来のゲノムの集合体である。
症例報告
炎症性腸疾患を伴わないPSCと診断された38歳の非喫煙者でお酒を全く飲まない男性(炎症性腸疾患は現在の症状の3か月前に大腸内視鏡による粘膜生検で除外された)は、3年間、15 mg/kg/日のウルソデオキシコール酸(UDCA)投与を受けていましたが、 過去 6 か月以内に 3 回細菌性胆管炎を発症し、最後の発症では敗血症性ショックのため集中治療室への入院が必要でした。磁気共鳴胆道造影では、Dominant strictureが存在しない肝臓のセグメント 3、6、および 8 の部分にビーズ状の領域を伴い、左右の肝管における粘膜不規則性が明らかになりました。免疫グロブリン タイプ G4 の血清レベルの検査は正常で、それに関連する全身症状はありませんでした。炭水化物抗原 19-9 のレベルは、胆管炎がなければ正常範囲内であり、胆管癌を示唆する(臓器の)実質または胆管の病変は、続く追跡画像では明らかではありませんでした。
再発性細菌性胆管炎を考慮して、患者は肝臓移植のリストに掲載されました。待機リストに載っている間に、患者は持続性のそう痒症(かゆみスコア 6/10)と黄疸を 3 か月間発症し、4 回目の 細菌性胆管炎の発症を経験しました。過去の3度の細菌性胆管炎発症のうち2度は、それぞれセファロスポリン(※注9)とカルバペネム(※注9)に感受性のある大腸菌菌血症に関連していました。最近の細菌性胆管炎の発症は、リネゾリド(※注9)に感受性のあるエンテロコッカス・フェカリスに関連しており、患者は臨床的な改善を見せました。肝臓移植 待機リストに載っていることに伴う高い死亡率を考慮し、患者とその妻からのインフォームドコンセントを得て、(PSC の疾患の進行に潜在的に影響を与えるため) 健康なドナーからの糞便微生物叢移植による腸内微生物叢の操作が検討されました。標準的な選考手続きの後、患者の甥が潜在的なドナーとして割り出されました。
(注9)セファロスポリン カルバペネム リネゾリド: 抗菌薬の種類
処置の6 時間前に60 グラムの新たに採取した便サンプルを取得し、250 mLの生理食塩水とブレンダーの中で 2 ~ 4 分間均質化しました。200 ミリリットルの漉され、濾過された便を内視鏡を通して患者の十二指腸の 2 番目の部分に送りました。内視鏡による糞便微生物叢移植を週1回、4週間実施しました。この期間中はすべての抗生物質が差し控えられましたが、UDCAは継続されました。
血液生化学、総血清胆汁酸および分画血清胆汁酸、および便微生物群の分析が、ベースライン時、予定された各 糞便微生物叢移植の前、および治療後 1 年の終わりに実施されました。マイクロバイオーム(微生物叢)分析は、標準プロトコルに従って結腸糞便サンプルに対して実施されました。簡潔に言うと、シーケンシングは Illumina MiSeq 次世代シーケンサー (Illumina、カリフォルニア州、米国) (※注10)で実行され、GreenGenes (※注11)データベース (バージョン 13.8) に従って分類学的に分類されました。各細菌群集の種の多様性を記述するためにシャノン多様度指数(※注12)が使用されました。一方でQuantitative Insights into Microbial Ecology (QIIME)(※注13)、Phylogenetic Investigation of Communities by Reconstruction of Unobserved States (PICRUSt)(※注14)、およびKyoto Encyclopedia of Genes and Genomes (KEGG) パスウェイ(※注15)が定量的および定性的な微生物群集とそれぞれの機能経路を確認するために使用されました。
(※注10) シーケンシングとは:
DNA(核酸)を構成する4つの塩基であるアデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の配列を決定する事。
次世代シーケンサーとは:
核酸(DNAとRNA)の塩基配列情報を読み取る装置(シーケンサー)の次世代型。塩基配列を大量に読み取ることができる。核酸の塩基配列には、生物やウイルスなどの遺伝情報が記録されている。
MiSeqはイルミナ社のデスクトップ型次世代シーケンサー
(※注11)GreenGenes:
キメラスクリーニング、標準アラインメント、および複数の公表された分類学を使用して系統学的分類を提供する16S rRNA 遺伝子データベースです。マイクロアレイ、プロトコール、シーケンス、文献、タキソノミー概要などの情報がダウンロードできます。
(※注12)シャノン多様度指数:
生物の群集の豊かさを表すのに、群集の中での種ごとの個体数の配分という考え方を多様度指数といいます。
シャノン・ウィナーの多様度指数は 種数が多く、均等度が高いほど値も大きくなります。
自然環境では0.5~3.5の値をとることが多いです。
(※注13)
QIIME (標準的には「チャイム」と発音されます) は、この分野で標準となっている多くのサードパーティ ツールを統合する、微生物群集分析を実行するためのパイプラインです。QIIME は、ラップトップ、スーパーコンピュータ、およびマルチコア デスクトップなどの中間システム上で実行できます。
(※注14)
PICRUSt (「パイクラスト」と発音) は、マーカー遺伝子 (16S rRNA など) の調査と完全なゲノムからメタゲノムの機能内容を予測するように設計されたバイオインフォマティクス ソフトウェア パッケージです。
PICRUSt はGPLに基づいて無料で利用できます。
(※注15)
KEGG(Kyoto Encyclopedia of Genes and Genomes:日本語では「京都遺伝子ゲノム百科事典」の意味)は、遺伝子やタンパク質、代謝、シグナル伝達などの分子間ネットワークに関する情報を統合したデータベースであり、バイオインフォマティクス研究(注16)に利用される。このデータベースは、細胞レベルでの生命システムの機能に関する知識を、分子間相互作用ネットワーク(代謝、シグナル伝達、遺伝情報等)の二項関係に基づいた情報としてデータベース化し (PATHWAY)、これを中心に据えているのが特徴である。さらに遺伝子カタログ情報 (GENES)、既知のタンパク質間の配列相同性情報 (SSDB)、機能的類似性情報 (KO)、生体関連化学物質に関する情報 (LIGAND) などに関する各データベースを統合し、単なるカタログ的データベースではなく、生命の設計図を構築するための知識ベースを目指している。
(※注16)バイオインフォマティクス:
バイオインフォマティクスはその名の通り、バイオ(生物学)とインフォマティクス(情報学)という2つの学問分野の接点にある、学際的学問分野である(図2)。大まかに言えば、対象が何らかの生命現象で手段が情報処理であるような分野である。
患者さんは、糞便微生物叢移植の3 回目と4 回目の期間の後にそれぞれ熱と黄疸が無い状態になり、1 年後までその状態が続きました。そう痒は、糞便微生物叢移植後 6週間まで悪化し (最大スコア 8/10)、その後 許容可能レベル (2/10) まで着実に減少しました。ベースラインから見ると特徴的な細菌群集とその機能の変化に関連した、肝機能の顕著な改善 (表1) および循環総胆汁酸と有毒胆汁酸 (表2)の顕著な改善が注目されました。ベースラインでは、プロテオバクテリア門(※注17)の相対量は患者の方が高かったが、バクテロイデス門とアクチノバクテリア門(放線菌門)は健康なドナーの方が多かったです。ビフィドバクテリウム属、コプロコッカス属、メガモナス属、およびバクテロイデス属はベースラインでドナーがより高かったが、エンテロバクター属、カテニバクテリウム属、およびダイアリスター属はベースラインで患者がより高かったことが注目されました。糞便微生物叢移植の期間中、プロテオバクテリア門の相対量の減少と、それに伴うバクテロイデテス門およびファーミクテス門の増加という顕著な変化が見られました。属レベルでは、ドナーで優勢だった細菌(バクテロイデス、メガモナス、ビフィドバクテリウム)が患者の糞便微生物叢移植中に増加し、ベースラインでは存在しなかった種(クロストリジウム、ベイヨネラ)が出現しました。ベースライン時に患者に存在していたいくつかの種(フェカリバクテリウム、オシロプシラ、ラクノスピラ)は、4週間の糞便微生物叢移植終了時には完全に消失していました。
(※注17)門:
生物分類学的階級の一つ。
界・門・綱・目・科・属・種の階級がある。私たちヒト(=Homo sapiens、1758年にリンネ(Linnaeus)が考案)という生物を生物分類の階級にしたがって表現すると、動物[界]脊索動物[門]哺乳[綱]サル[目]ヒト[科]ヒト[属]ヒト(sapiens)[種]となる。以下のサイトが生物分類学的階級について詳しいので、興味がある方は参考になさって下さい。
また、人の腸内細菌の門は大きく分けて
Firmicutes門、Bacteroidetes門、Proteobacteria門、Actinobacteria門の4つの門に分類されます。
表1
原発性硬化性胆管炎および再発性細菌性胆管炎を患う患者における、ベースライン時、糞便微生物叢移植中および移植完了後の肝機能検査値
|
時間 |
総ビリルビン (mg/dL) |
直接ビリルビン (mg/dL) |
アスパラギン酸トランスアミナーゼ AST(IU/L) |
アラニントランスアミナーゼ ALT(IU/L) |
アルカリホスファターゼ ALP(IU/L) |
ガンマグルタミルトランスフェラーゼ γ-GTP(IU/L) |
血清アルブミン (g/dL) |
国際標準化比(注18) |
|
ベースライン |
6.8 |
4.2 |
88 |
128 |
456 |
332 |
3.2 |
1.46 |
|
FMT の第 1 週が終了 |
7.2 |
4.8 |
92 |
132 |
502 |
288 |
3.1 |
1.42 |
|
FMT の 2 週目の終わり |
6.8 |
3.1 |
90 |
112 |
662 |
292 |
3.1 |
1.51 |
|
FMT の 3 週目の終わり |
4.3 |
3.2 |
97 |
118 |
886 |
342 |
2.9 |
1.61 |
|
FMT の第 4 週の終わり |
3.6 |
2.2 |
94 |
132 |
792 |
316 |
3.2 |
1.48 |
|
FMT 後 3 か月 |
2.8 |
1.6 |
78 |
98 |
344 |
189 |
3.4 |
1.32 |
|
FMT 後 6 か月 |
1.8 |
0.9 |
72 |
68 |
286 |
184 |
3.4 |
1.34 |
|
FMT後9ヶ月 |
2.0 |
0.8 |
66 |
56 |
214 |
164 |
3.2 |
1.28 |
|
FMT 後 12 か月 |
9.4 |
4.9 |
79 |
97 |
352 |
246 |
3.1 |
1.64 |
(※注18)
肝機能検査項目の1つにプロトロンビン時間(PT)があり、その値から国際標準化比(INR)を算出します。PTとINRは、どちらも血液が凝固するのにかかる時間に基づく指標です(肝臓では、血液凝固因子と呼ばれる血液凝固に必要なタンパク質のいくつかが合成されます)。PTまたはINRの異常値は、急性または慢性肝疾患の存在を示している可能性があります。急性または慢性肝疾患がある人では、PTまたはINRの高値は、一般的には 肝不全への進行を意味します。
表2
原発性硬化性胆管炎および再発性細菌性胆管炎を患う患者における、ベースライン時、糞便微生物叢移植中および移植完了後の総胆汁酸および分画胆汁酸
|
時間 |
総胆汁酸 (μmol/L) |
コール酸(μmol/L) |
デオキシコール酸 (μmol/L) |
ケノデオキシコール酸 (μmol/L) |
|
ベースライン |
86.4 |
33.6 |
<0.5 |
52.8 |
|
FMT の第 1 週が終了 |
73 |
18.7 |
2.6 |
51.7 |
|
FMT の 2 週目の終わり |
55.9 |
15.5 |
<0.5 |
40.4 |
|
FMT の 3 週目の終わり |
64.5 |
17.9 |
<0.5 |
46.6 |
|
FMT の第 4 週の終わり |
52.6 |
18.4 |
<0.5 |
32.8 |
|
FMT 後 6 か月 |
48.7 |
21.9 |
1.3 |
24.4 |
|
FMT 後 12 か月 |
68 |
18.8 |
<0.5 |
48.7 |
|
基準範囲 |
≤6.8 |
≤1.8 |
2.4 |
3.1 |
膜輸送に関連する経路、特に ATP 結合カセット輸送体(※注19)と細菌の運動性に関連するタンパク質は、糞便微生物叢移植後に変化しました (図1)。糞便微生物叢移植の1年後、胆管炎が再発しましたが(血液培養陽性が除外された場合は広域抗生物質で治療)、腸内微生物群集における顕著な病原性変化と、ベースラインでは患者にもドナーにも認められなかった病原種の出現が見られました。患者は糞便微生物叢移植の 2 サイクル目を勧められましたが、拒否し、精密検査と肝臓移植待機リストへの再登録のために 肝臓移植センターに照会されました。
(※注19)ATP結合カセット輸送体 (ATP-binding cassette transporters):
ATPのエネルギーを用いて物質の輸送を行う膜輸送体の一群である。構造的特徴を共有する非常に大きなタンパク質スーパーファミリーをなし、現生のすべての生物に存在する。ABC輸送体、ABCトランスポーター 、ABC蛋白質とも呼ばれる。
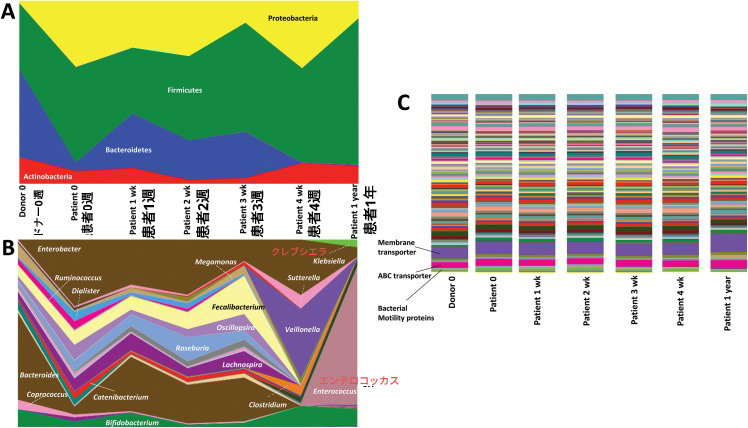
【図1】
(A) ベースライン時、健康なドナーからの糞便移植中および移植後 1 年後の患者の糞便サンプルのメタ16s解析(注20)における主要な細菌門の面積図。
(B) ベースライン時、健康なドナーからの糞便移植中および移植後 1 年後の患者の糞便サンプルのメタ16S解析における主要な細菌属の面積図。
(C) 健康なドナーからの糞便移植中および移植一年後に、ベースラインから上方制御および下方制御された複数の代謝経路のヒストグラム表示。
(※注20)メタ16S解析:
次世代シーケンサーを用いた腸内細菌叢の解析は、全ゲノム配列を網羅的に解読するメタゲノム解析と、ゲノム中の16S rRNA 遺伝子配列のみを解読するメタ16S解析に分けられる。メタ16S解析では菌の機能に関する情報は得られないものの、必要とするデータ量が少ないため、安価に大量のサンプルを解析することが可能である。
議論
PSC に対する健康なドナーの糞便微生物叢移植は、微生物叢の多様性とPSCにおける肝臓の生化学を改善することが最近示されました。Bajerと共同研究者らは、炎症性腸疾患を併発しているかどうかに関係なく、PSC患者ではRothia、Enterococcus,、Streptococcus(レンサ球菌) およびVeillonellaが著しく多いのに対し、Coprococcus、Adlercreutzia、Prevotellaは減少していることを示しました ; これは、ベースラインでの私達の調査結果と多かれ少なかれ似ていました。
Pereiraらは、PSCの病因は胆汁微生物群集の変化とは関連しておらず、Streptococcus(レンサ球菌)が疾患の進行において潜在的に病因となる役割を果たしていると示唆しました。
PSCにおける糞便微生物叢移植による一年間の無移植生存期間(transplant-free survival ;TFS) と再発性急性細菌性胆管炎の改善は実証されていません。
PSC患者では、血清アルカリホスファターゼの改善(自然に、またはより頻繁にUDCA療法によって)が予後の改善につながることが、複数の研究で示されています。しかし、UDCA治療に関するより大規模なプラセボ対照研究では、症状や移植までの時間に対する影響は実証されませんでした。 15年間の追跡調査を伴うPSCに関する最大規模の多施設共同研究の結果は、臨床事象や無移植生存期間の改善においてUDCAが役割を果たしていないことを裏付けました。最近の分析では、高用量のUDCAを投与されたPSC患者における強力な疎水性胆汁酸であるリトコール酸の血清濃度の上昇が有害転帰と関連していることが判明したため、28mg/kgを超えるUDCA投与量は削減されました。
PSCにおける抗生物質療法は、とりわけ PSCの発症に関して腸内微生物叢の役割が認められるという証拠が増えていることから、有望であると思われます。しかし、耐性の進化と病気の進行の予防の問題は依然として臨床医にとって大きな懸念事項です。UDCAと環状抗生物質を併用しても急性細菌性胆管炎の症状や肝臓生化学が改善しなかった患者さんは、糞便微生物叢移植の利用によって肝臓生化学だけではなく、臨床的にも改善しました。
私たちの患者では、門レベルでプロテオバクテリア (多数のヒト病原体を含む門) が減少し、ファーミクテス属 (有益な免疫学的特性を持つと推定される多くの分類群を持つ門) が増加しています。この事は明らかに PSCにおける糞便微生物叢移植を支持するでしょう。しかし、属レベルではクレブシエラ菌とエンテロコッカス菌の増加が見られます。これらは炎症促進性の腸内作用を有しており、PSC における細菌性胆管炎の重要な腸内病原菌の供給源を構成していると考えられます。さらに、定評のある有益な免疫調節効果を持つ分類群を産生する酪酸である、フェカリバクテリウム と ローズブリアが時間の経過とともに患者において減少することが報告されています。しかし、これは潰瘍性大腸炎の患者でのみ実証されており、PSC の患者では実証されていません。それにもかかわらず、糞便微生物叢移植後の数カ月の間、病原性の細菌が進化していても 、有益な代謝機能経路は依然とし活性化しています。したがって、単に病原種が存在する事だけでは臨床的な転帰を真に反映していない可能性がありますが、この事は微生物叢の機能に影響を与える可能性があり、それはより重要な事です。
私達の患者さんにおける自然発生的な病原性の変化の背後にある理由は、現時点では明確に説明できません。この影響は、疾患の病因である他の活発な「要因」によって長期的に有益な種の共生が失敗したことに起因する二次的なものである可能性があります。このことは明らかにPSC における糞便微生物叢移植の有益な効果に疑問を呈するか、少なくとも糞便微生物叢移植は無移植生存期間を延長するための短期的な手段としては有用かもしれないが、長期的な解決策としては適切ではないと主張するでしょう。;中長期的には不利になる可能性さえあります。 無移植生存期間における改善を裏付ける重要な所見は、循環胆汁酸に見られる顕著で有益な変化とアルカリフォスファターゼの初期の減少であるかも知れません。急性細菌性胆管炎の長期における自然治癒は、あり得ることではあるものの、この疾患の自然史では十分に実証されておらず、PSC患者において、細菌性胆管炎の再発が生命を脅かす転帰をもたらすことはよく知られています。
私達の患者さんにおいては、再発性細菌性胆管炎と、糞便微生物叢移植の後の丸一年の間のその改善は、治療後の改善と変化についての臨床的、生化学的、メタゲノム的な証拠を伴うものでしたが、私達の研究結果を確かめるためには、この問題に対するより大規模な研究が必要ではあるものの、この事は、症状の無い期間や無移植生存期間は、単に偶然によって生じたものではない事を示す概念的な証明となっています。糞便微生物叢移植一年後、患者さんに急性細菌性胆管炎が再発した事は微生物叢が疾患の進行と発現の”要因”の一つであるかもしれない事を示唆していると思われます。;しかしながら、他の要因がPSCにおける腸内毒素症の開始と維持に関連している可能性がありますし、あるいは糞便微生物叢移植の効果は短期間では限界があるのかも知れません。
これらの問題は、PSCのスペクトラム(連続した広がり)を完全に理解するために、宿主要因と環境要因を考慮して、マルチオミクス(※注21)を統合した研究を用いた更なる調査を必要としています。
(※注21)マルチオミクス:
生体内の機能を担うさまざまな物質について、総合的・網羅的に研究する学問分野。具体的にはDNA・RNA・たんぱく質・代謝産物などを分析対象とし、それぞれゲノミクス・トランスクリプトミクス・プロテオミクス・メタボロミクスに分類される。マルチオミックス。統合オミクス。
結論
私達は、進行した肝硬変や代償不全の無い、再発性急性細菌性胆管炎を伴うPSCの患者さん達が無移植生存期間の延長を通じて糞便微生物叢移植から利益を得られるのではないかと考えています。この事は、移植待機リストの負担を軽減する可能性があり、その結果、より高い肝疾患重症度スコアの人達に対するより適切な臓器の割り当てが実現されるかもしれません。より大規模な研究が未だ満たされていないニーズ(Unmet Need)です。




