以前『抗生物質バンコマイシンによるPSCの治療』
というブログ記事の中で紹介した、
『Successful response of primary sclerosing cholangitis and associated ulcerative colitis to oral vancomycin may depend on brand and personalized dose: report in an adolescent : 経口バンコマイシンに対する原発性硬化性胆管炎および関連する潰瘍性大腸炎の反応の成功は、ブランドと個別に調整された用量に依存する可能性がある(2020年11/24公開)』
という論文について詳しく見ていきたいと思います。
この論文は有料論文なので著作権の関係上、全文を掲載することは出来ないので、一部抜粋と概要を紹介しようと思います。
先ず、この論文の概要は
・14歳で潰瘍性大腸炎と診断され、15歳でsmall duct PSC(※1)と診断された患者さんが1日2回の経口バンコマイシン1000mgの投与によって、下痢、体重減少、疲労が回復し、肝酵素の正常化、および結腸内視鏡所見の正常化が見られ、MRCPでは正常な胆管を示し、磁気共鳴エラストグラフィー(非侵襲的に組織の硬さを画像化する機能)の値は正常範囲内を示すようになり、その効果は論文が公開された2020年まで8年間続いている。
(※1)small duct PSC (小管PSC) : 胆管造影で異常を認められず,肝生検でのみ診断されるPSCとして欧米で知られている。一般に、large duct PSCより穏やかな経過を辿る。
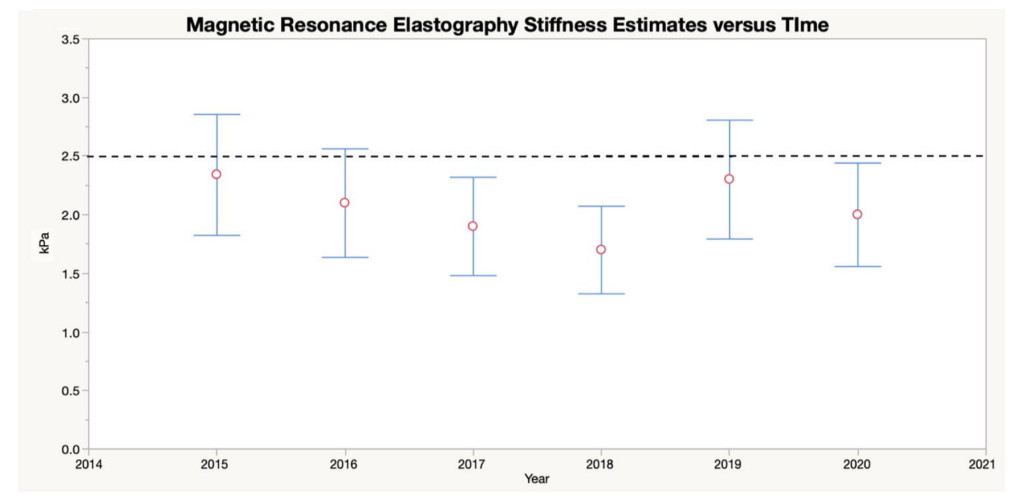
【図1】
磁気共鳴エラストグラフィーの経時変化。赤い丸は測定された肝臓の硬さをキロ パスカル(kPa)で表しています。エラーバー(工の形の縦棒)は95%信頼区間(※)を表します。点線は通常の硬さの上限を表します。
※信頼区間とは:
データの平均(標本平均)から母集団の平均(母平均)がどれくらいか,といった範囲を推定する指標が信頼区間です.95%信頼区間とは,95%の確率で母平均がその範囲に含まれることを表しています.たとえば,脳卒中片麻痺患者10名の健側握力を測定して,95%信頼区間が14.7kg~23.2kgであったとき,n=∞のときの脳卒中片麻痺患者の健側握力は95%の可能性で14.7kg~23.2kgの間に存在すると推定できます(以下のサイトより引用 https://onl.bz/y191jjT).
・(図2左)15歳の時のMRCPではグラディエントエコースキャンで総胆管に7mmまでの拡張が見られるが、22歳時のEovist(MRI造影剤)後のスキャン(図2右)では総胆管の拡張が解消され、4.7mmになっている。
但し、7mmの拡張はオッディ括約筋の痙攣のような生理学的なものなのか、真に解剖学的なものだったのかは不明と言う事です。
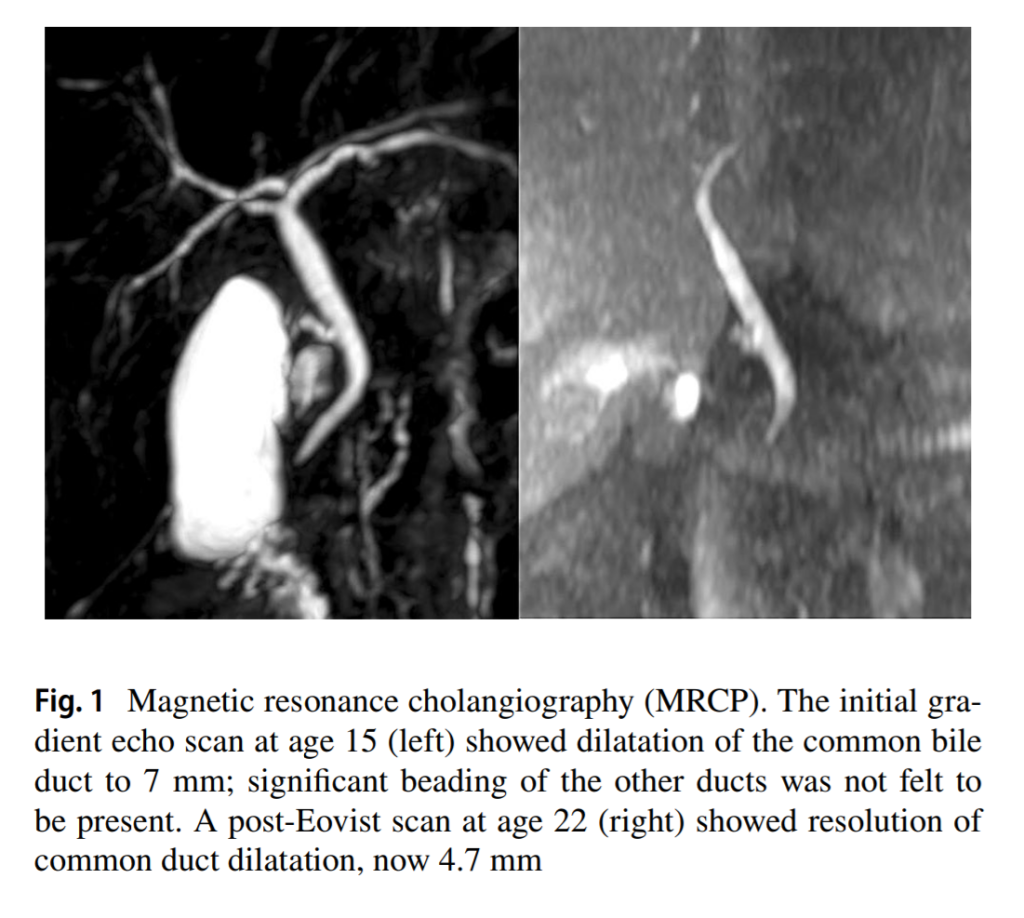
【図2】
・ジェネリックのバンコマイシンの投与は一定程度の効果はあるが、患者さんの肝機能検査値を完全に正常化することに成功した先発薬のバンコマイシン程の効果はない。
・先発薬のバンコマイシンも製造施設が変わってからは、以前程の効果が無くなってしまったが、患者さんが薬を飲む前に自分でカプセルを開いてから服用すると以前と同様に高い効果を発揮した。バンコマイシンは、放線菌の分泌物からの薬物の製造という複雑で繊細なプロセスを伴って作られる医薬品なので、その有効性が製剤方法や製造技術によって大きく影響を受ける薬だと思われる。ジェネリック医薬品において、先発薬程の効果を得られない理由として、そのようなプロセスをコントロールするために先発薬企業が実践している独自のニュアンスを、ジェネリックメーカーは知ることができないためと考えられる。カプセル剤では無く、液剤という剤形であれば、カプセルの溶解特性の問題を回避出来るのでは、と著者は述べている。
・バンコマイシンのPSC治療に対する有効性を調査した研究で結果が様々に異なる原因は、バンコマイシンの製造メーカーによって薬の効き目が異なること、バンコマイシンの最適な服用量が個人によって異なること、MRCPやエラストグラフィーでの改善を考慮していない研究も含まれること、調査期間が十分でない事などが考えられる。
《ブログ主の見解》
ジェネリック医薬品と先発薬では効き目が異なるというのはバンコマイシンに限らず、他の医薬品でも大いに可能性がある事だと思います。
ジェネリック医薬品は先発医薬品(新薬)の特許が切れた後に製造・販売される、「先発医薬品と同じ有効成分を同量含んでおり、先発医薬品と同等の効き目がある」と認められた医薬品とされていますが、特許期間が切れているのは多くの場合、医薬品の有効成分に関わる物質特許のみで、製造方法に関わる製法特許、製剤特許はまだ特許期間が満了してないケースが多いです。その場合、薬をコーティングする技術、またコーティングに使用される添加物、有効成分を安定化する添加物、有効成分の吸収を助ける添加物などを先発薬と同じにすることは出来ません。そうなると有効成分が何処で溶け出し、患部にどれだけ留まるかという医薬品の効果を左右する性質を先発薬と全く同じにすることは出来ません。
薬が何処でどんなスピードで溶け出し、吸収されるかはその薬の使用目的すら変えてしまう非常に重要な要素で、これは極端な例ではありますが、同じ酸化マグネシウムでも、それが胃で溶け出せば、制酸剤(胃薬の一種)として胃粘膜の保護に働き、大腸で溶け出せば、瀉下薬(便秘薬)として糞便の排出を助けるという風に、溶出する組織によって全く異なる働きをします。
一応、ジェネリック医薬品は、有効成分の純度や量を確認する品質試験、医薬品から溶け出した有効成分の量を確認する溶出試験、血液中の有効成分の濃度を比較する生物学的同等性試験、温度や湿度などによる状態変化が基準内であるかを確認する安定性試験という4つの試験によって先発薬と同等な効果があると国から認定されているのですが、生物学的同等試験は、先発薬とジェネリックを投与された被験者における医薬品有効成分の血中濃度を比べて、それが同じならば、治療効果も同じだろうという解釈に基づいて定められている試験なので、あくまで血中濃度の同等性を調べる試験であり、治療効果そのものの同等性を調べる試験ではありません。また、被験者の体質、体調によって結果にばらつきが出ることを考慮して血中濃度の80%~125%までの差異は許容域として「統計学的には差がない」と容認された上での「同等」なので、厳密な意味での「同等」ではありません。
正確な血中濃度のコントロールが必要とされる、免疫抑制剤、抗悪性腫瘍剤、催眠剤、向精神薬、血圧降下剤、糖尿病剤などではジェネリック医薬品の使用は避けたほうが良いようです。
飲まない方がよいジェネリック医薬品を調べるにあたって、大木皮膚科さんのブログを参考にさせて頂いたのですが、
大木皮膚科さんのブログは公的機関ではなく一般の医療機関のブログなので、直リンクする事は出来ませんが、ジェネリック医薬品の問題点や、良い点の両方についてとても詳しく説明されているので、興味がある方は、「大木皮膚科 ジェネリック」のキーワードで検索してみて下さい。患者さんの安全を第一に考えたとても信頼のおけるお医者さんだと思われます。
また、日本小児神経学会では、2008年に
1. 先発医薬品と後発医薬品の治療的同等性を検証した質の高いエビデンスはない。
2. 一部の患者で、先発医薬品と後発医薬品の切り替えに際し、発作の悪化、副作用の出現が報告されている。
などの理由から、
「てんかん患者の抗てんかん薬治療においては、先発医薬品と後発医薬品、あるいは後発医薬品同士の切り替えに際して、医師および患者の同意が不可欠であるとともに、充分な情報提供が求められる。」という提言を行っているようです。
更に、ジェネリック医薬品は製造コストを下げて安価な商品を提供するために、原薬を中国、韓国、インドなどの海外で製造している事が多く(先発薬でも海外製の原薬を使用しているものも一部有り)、適正製造基準の検査は実地ではなく、書面だけで通ってしまう事もあると言うことなので品質面や安全面に懸念が残ります。
ジェネリック医薬品の製造メーカーの中でも大手に関しては、品質管理や安全管理にコストをかける資金力があり、信頼できる企業もあるようですが、それらの企業であっても原薬の製造拠点は海外なので、相手国の状況によって供給がストップしてしまい必要な時に手に入らないという事態も考えられますので、安定供給の面では不安が残ります。
国が医療費の削減のために、ジェネリック医薬品の普及を推し進めていて、定められた割合以上のジェネリック医薬品の処方箋枚数を達成出来なかった薬局には「調剤報酬の減額」というペナルティーが課されるので、薬局からはジェネリック医薬品の使用を勧められる事が多いと思いますが、
命に関わる重篤な疾患である場合、極力、先発薬を選んだ方が安全だと思われます。
続いては、経口バンコマイシンによるPSC治療を受けた患者さんの、治療開始までの経緯と開始後の経過を記していきます。
・この患者さんは全てカプセル剤による経口バンコマイシンの投与を受けました。液剤での投与はありませんでした。
・全体を通して「バンコシン」という名称はもともとはイーライリリー社によって開発され、ViroPharma社にライセンス供与され、後にはANI Pharmaceuticals社にライセンス供与された先発医薬品のバンコマイシンに言及する時に使います。
・また、ViroPharma社とANI Pharmaceuticals社のジェネリックブランドも先発医薬品と同一のもの(※)なので他のジェネリック医薬品と差別化する為に、「バンコシン」と呼びます。
※ブログ主注釈: ジェネリック医薬品の中でもオーソライズド ジェネリック (AG)と呼ばれるものだと思います。先発薬メーカーから許諾を得て、有効成分、製造方法、製造技術、添加物、製造ラインなどが全て先発医薬品と同一の条件で作られたジェネリック医薬品です。
・その他のジェネリックブランドはシンプルに「ジェネリック バンコマイシン」と呼びます。
2010年4月、患者さんが13歳の時に、ニキビ治療のために、毎日、ドキシサイクリンの投与を開始しました。その4ヶ月後に彼女は血の混じった下痢の症状を呈しました。
ドキシサイクリンとPSCの関連性については以前からその可能性を提起されています。
シプロフロキサシン、メトロニダゾールで10日間、ニタゾキサニドで4日間治療すると症状は改善したが、これらの薬の投与をやめてしまうとまた症状が再発しました。
それからも彼女はドキシサイクリンを服用し続け、5ヶ月後に結節性紅斑の初期症状で入院しました。
この時、彼女のアラニンアミノトランスフェラーゼ(ALT)は56〔正常の上限は35 IU/L〕、アルカリフォスファターゼ(ALP)は190〔正常の上限は119IU/L〕、核周囲の抗好中球細胞質抗体(p-ANCA)陽性、総ビリルビン、直接ビリルビンは正常で結腸内視鏡生検で結腸全体に中程度の慢性活動性大腸炎と回腸末端と盲腸における急性及び慢性炎症が示されました。
ドキシサイクリンの服用をやめると結節性紅斑は解消しました。
彼女はメサラミンの投与を開始しましたが、それにより血の混じった下痢と腹痛が悪化し、その後のブデソニド、それに次ぐバルサラジドによる治療も下痢の悪化を引き起こしたので、全ての投薬治療を中止する事を選択し、VSL#3プロバイオティクス、クルクミン、サボテンジュースによる6ヶ月間の非処方薬治療を始めました。しかし、彼女は1日に最大4~5回の下痢を経験し続けブリストルスケールはタイプ7でした。

【図3 ブリストルスケール】
2012年7月、15歳の時、彼女は潰瘍性大腸炎に対するアザチオプリン療法の開始のためにスクリーニング血液検査を受け、肝機能検査の値がALT221 IU/L(基準値7-35)、ALP221 IU/L(基準値45-119)、AST88 IU/L(基準値8-41)、GGT397 IU/L(基準値9-29)まで上昇している事が明らかになりました。MRCPでは肝門部近くに総胆管の7mmの拡張が見られましたが、他にPSCを示唆する変化は無く、肝内の大きな管の関与も見られませんでした。肝生検を行ったところ、同心性線維症と胆管増殖を伴う門脈へのリンパ球の浸潤が認められたので、small duct PSCと診断されました。
患者さんは潰瘍性大腸炎に対するアザチオプリンに加えて、ウルソデオキシコール酸(UDCA)300mg1日2回の投与を開始して、肝臓の検査値は改善したが、正常化はしませんでした。アザチオプリンの投与開始から10日以内に吐き気、嘔吐、心窩部痛の症状を呈したため、アザチオプリンを中止する事でこれらの症状は解消しましたが、下痢は続きました。
2012年、10月、以下の論文に基づいてカプセル剤の形で経口バンコマイシン500mgを1日3回(35mg/kg/日)投与するテストを開始しました。
『経口バンコマイシン:免疫調節抗生物質による小児原発性硬化性胆管炎の長期治療』
UDCAに対する生化学的反応が部分的にしかなかったのでUCDAは中止されました。
以降、経口バンコマイシンのみによる治療が続きます。
下のグラフのポイントA~Iの時点での出来事を解説していきます。
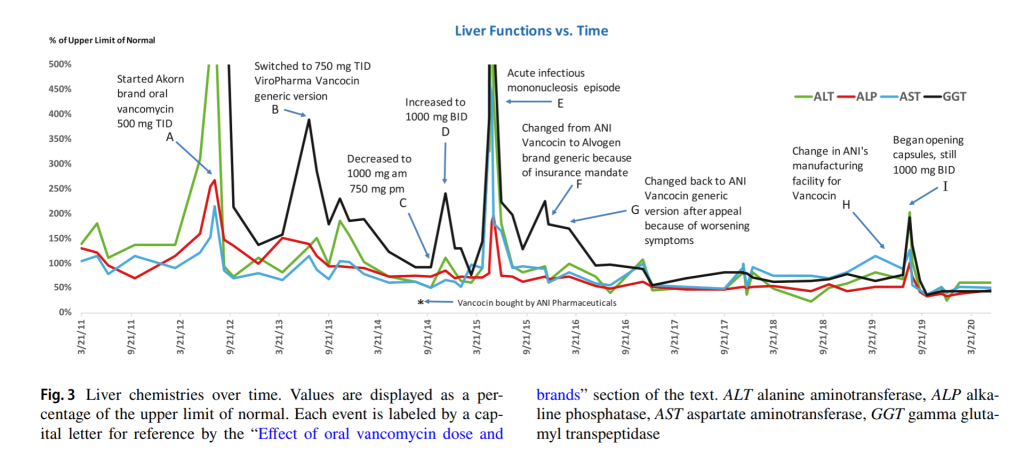
【図4】
〘ポイントA〙
上記の経口バイコマイシン投与の開始はの図4のポイントAにあたります。この時服用した薬はジェネリック医薬品の経口バンコマイシンでAkron Pharmaceuticalsのものになります。これにより2週間以内に下痢は治まり、便は硬くなり(ブリストルスケールタイプ4)、患者さんの体重は増加しました。
そして、バンコマイシン経口投与5ヶ月後の肝機能検査値は大きく改善し、
ALT 9 IU/L (基準値 7–35), ALP 180 IU/L (基準値 45–119), AST 27 IU/L (基準値 8–41), GGT 46 IU/L (基準値 9–29)でした。
〘ポイントB〙
2013年、8月。トランスアミナーゼ(※)が完全に正常化していなかったので、用量を750mg1日3回(40mg/kg/日)に増量しました。いくつかのジェネリックブランドで、一部の患者さんの腸内での濃度が異なるという事があったので、ジェネリックバイコマイシンをViroPharma, Inc.の経口バンコシン(先発薬、若しくは先発薬と同等のもの)に変更しました。
患者さんの肝機能は、ガンマ-グルタミルトランスフェラーゼ(GGT)が55 IU/L (通常の上限値は 29 IU/L)と軽度に上昇した事を除いて正常化しました。
※トランスアミナーゼ: アミノ酸からアミノ基を取ってケト酸(2-オキソ酸)にし、アミノ基を他のケト酸に与えてアミノ酸にする酵素の総称。ALP、ALT、GGTなど。
〘ポイントC〙
2014年10月。用量を朝1000mg夜750mgに減らしたところ、肝機能検査値が急上昇しました。
〘ポイントD〙
2014年、11月。1000mgを一日2回(35mg/kg/日)に増量しました。肝機能検査値は完全に正常化しました。
〘ポイントE〙
数ヶ月後、急性伝染性単核症により偶発的に一時的な肝機能検査値の上昇が起こりました。
〘ポイントF〙
2016年、1月。バンコシンの保険適用が継続されなかったため、Alvogenブランドのジェネリックバイコマイシンカプセルに切り替えました。患者さんは2週間以内に軟便と肝機能検査値の上昇を経験しました。
〘ポイントG〙
翌月、薬をバンコシンに戻しましたが、その時、ライセンスはANI Pharmaceuticalsによって取得されていました。彼女の便と肝機能検査値は再び正常になりました。
〘ポイントI〙
2019年7月。彼女はバンコシンの投与を続けていたのに軟便を経験し、肝機能検査値が上昇しました。
GGT 46–83 U/L (正常値の上限は60 U/L未満)で、 カルプロテククチンは38.2–423.8 μg(正常値の上限は50 ʯg未満)でした。
彼女は、最初、用量を750mg1日3回に増やし、それから、1000mg1日3回に増やしましたが、彼女の腸の症状も肝機能検査値も改善しませんでした。
ANI Pharmaceuticalsがその年の第2四半期に製造施設の場所を変更していた(ポイントH)のを知ったあと、おそらくはカプセル化の方法の変化に関与していると思われる製造施設の変更が腸におけるバイオアベイラビリティの(※)問題の原因になっている事を疑って、患者さんはカプセルを開けてから薬を摂取し始めました。
※バイオアベイラビリティ: 人体に投与された薬物のうち、どれだけの量が全身に循環するのかを示す指標。生物学的利用能ともいわれる。
2週間以内に彼女の肝機能検査値は正常化し、胃腸の症状は完全に解消し、カルプロテククチンは73.4μg(正常値の上限は50 ʯg未満)まで減少し、次の2週間で正常化しました。
彼女は薬の投与量を通常通りの1000mg1日2回に戻し、バンコシンのカプセルを開けて、服用し続けました。
PSCの診断から8年後のサーベイランスMRCPスキャンでは、正常な肝内胆管を持つ正常な肝臓が示されました。総胆管の拡張も解消されていました。磁気共鳴エラストグラフィーの結果は正常の範囲内でした。その後の毎年のサーベイランス結腸内視鏡検査では、生検で休止状態~軽度の慢性大腸炎しか示されませんでした。2020年9月の時点で彼女の結腸内視鏡検査と生検は肝機能検査値と同じく正常でした。
ALT 20 IU/L (基準値 10–35), ALP 51 IU/L (基準値 35–105), AST
26 IU/L (基準値 10–35), and GGT 22 IU/L (基準値<40)



